克罗恩病患者肠切除术后的管理策略
发布日期:2018-04-03
克罗恩病(CD)是一种进展性和破坏性疾病,患者常会面临手术治疗的风险。在CD患者术后管理过程中,需要多学科团队的参与。消化内科医师在克罗恩病手术管理中,起到主导及转承的作用,扮演着重要的角色。
来自中山大学附属第六医院的高翔教授,在西安杨森免疫学术论坛上做了“克罗恩病患者肠切除术后的管理策略”的发言
CD患者肠切除术后的实际情况复杂多样:
有些患者完全切除病变肠段,进行回结肠吻合口
有些患者只切除病变最严重肠段,还有残余病变肠段(通常有造口)
有些患者可能术前有较严重的腹腔内感染
有些患者可能有术后并发症(瘘、脓肿形成)等
因此要根据不同的情况,进行具体的分析讨论:
(一)完全切除病变肠段,回结肠吻合
CD是一个慢性进展性的疾病。一项瑞士的IBD队列研究,纳入了2006年至2011年间,1138例IBD患者。研究发现,发病10年手术率约40%,发病20年手术率约70%。10年二次手术率约为25%,20年二次手术率约50%。另一项研究结果显示,CD患者术后内镜复发的中位时间为16.9个月。
未接受药物治疗的CD患者,大约75%需要进行肠切除手术治疗。已经接受过手术的患者,约70%因为复发或并发症需要二次手术。
因此可见,CD术后复发是一个需要关注的问题。预防复发的管理策略至关重要。CD术后预防复发的关键问题如下:
哪些患者需要预防性治疗?
开始预防性治疗的时间?
用什么药物预防?
如何监测复发?
哪些患者需要预防性药物治疗
ECCO指南指出,吸烟、有肠道手术史、未进行预防性治疗、手术时存在穿透性疾病、肛周脓肿、手术病理标本发现肉芽肿及存在肌间神经丛炎是术后早期复发的预测因素。
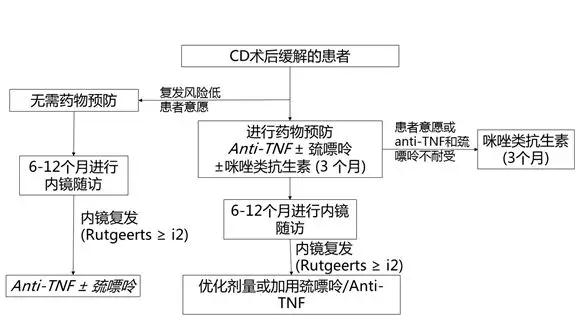
ECCO指南还指出,存在至少一种复发危险因素的患者,应该使用巯嘌呤或anti-TNF进行预防性治疗。
研究表明,术后复发的高风险CD患者约占83%。绝大多数患者存在术后复发的危险因素。另一项研究结果显示,有两个及以上风险因素的患者,术后内镜复发率为没有或仅具有一个风险因素患者的2.8倍。
中山六院的研究发现,具有术后复发高危因素的患者,临床复发率和内镜复发率都高于没有高危因素的患者。术后使用硫唑嘌呤类药物预防的患者,内镜复发率显著低于使用美沙拉嗪预防组的患者。
什么时候开始预防治疗?
早在术后1周,就有可能发生组织学的改变。1年内出现内镜复发的概率为60%。因此,应尽早开始预防治疗。预防性药物治疗开始的时间越迟,越容易造成不可逆的组织损伤。
ECCO及AGA均推荐尽早开始治疗:
ECCO指南指出,应在术后2周内开始预防性治疗。
AGA指南指出,CD术后缓解的病人,建议早期在内镜指导下进行药物预防。
用什么药物进行预防性治疗?
ECCO及AGA共识意见:
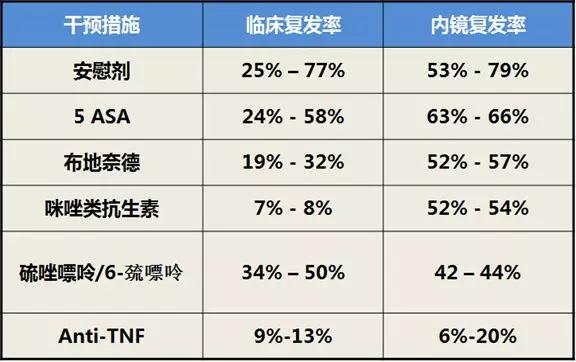
ECCO指南推荐使用巯嘌呤类药物和anti-TNF进行术后预防。高剂量美沙拉嗪可用于回肠切除患者。咪唑类抗生素也被证实对预防术后复发有作用,但患者耐受性不佳。
AGA指南也推荐使用抗-TNF类药物或(和)巯嘌呤类药物预防CD术后复发。不建议使用美沙拉嗪、布地奈德或抗生素。
综合各研究结果可以得出,预防内镜复发,抗-TNF药物的疗效最佳。研究证实,对于CD术后缓解的患者,随访76周,使用抗-TNF的患者,内镜复发率显著低于对照组患者。
如何监测CD术后复发:
早期复查内镜(6-12m)监测术后复发:研究发现,内镜下Rutgeerts评分与临床复发有显著的相关关系。Rutgeerts评分i4的患者,术后复发风险最高;iI2和i3的患者,术后48个月复发风险类似;i0和i1的患者,术后复发风险最低。
粪便钙卫蛋白(FC)监测术后复发:2015年发表于Gastroenterology 杂志的研究发现,CD术后患者,术后6个月、18个月,发生内镜复发的患者,粪便钙卫蛋白含量显著高于未复发的患者。
粪钙卫蛋白低于 135 ug/g(Best cut-off value),可以预测CD术后内镜复发。阴性预测值 91%,敏感度 87%,AUROC 0.763 。粪钙卫蛋白低于 100µg/g (临床实用性),可以预测CD术后内镜复发。阴性预测值 91%,敏感度 89%, AUROC 0.763
影像学检查:CTE、MRE、胃肠道彩超。影像学检查有助于发现肠道外并发症,对肠镜的有效补充
AGA 推荐的CD术后管理模式:
分享一例临床病例:
女性患者,24岁。主诉:反复腹痛4年余。诊断:克罗恩病(回末型 穿透型 活动期中度)。
现病史:2013年开始出现脐周疼痛,伴腹胀,偶有呕吐,并逐步加重。2016年8月外院查小肠镜提示回肠末段溃疡并肠腔狭窄,CTE提示回肠中下段及回盲部多发节段性病变,诊断克罗恩病,予AZA+IFX治疗4程,仍有腹痛腹胀,腹部鼓包。2017年2月外院予口服全肠内营养治疗3个月,同时AZA 75mg治疗,腹痛稍好转,但仍有腹部肠型。2017年6月至广州中山六院就诊。
查体:腹软,右下腹有压痛,无反跳痛。
入院后检查:HBG 92g/L WBC 6.17×10E9/L N 63% PLT 216×10E9/L ALB 38.44 g/L 超敏CRP 1.07 mg/L 血沉 38 mm/h BMI 23.6 kg/m2
肠镜提示:回肠末段黏膜稍僵硬,可见数条白色疤痕,另见黏膜散布颗粒样增生,未见溃疡;盲肠-升结肠黏膜稍质脆,触之易出血。
术前MRE提示:克罗恩病活动期,受累肠管为第6组部分小肠、回肠末端;第6组部分小肠粘连,多段回肠扩张积液,提示肠梗阻,梗阻点可疑位于第6组小肠。
手术探查腹腔:入腹见距回盲瓣约90cm小肠水肿,系膜缘增厚,相应系膜肥厚,其间见3处节段性狭窄,近端小肠积液积气、扩张明显。近端小肠约 4.2m,除扩张外,未见明显增厚、狭窄及穿透性病变。
术中诊断克罗恩病,主要累及末段回肠。根据术中探查决定行小肠部分切除+右半结肠切除术。
术后病理提示:(右半结肠及部分小肠)病变处可见裂隙状溃疡,粘膜内隐窝排列紊乱,结构扭曲、变形 ,可见幽门腺化生,可见肠壁全层透壁性炎,淋巴小结增生,病变符合Crohn’s病。
术后予AZA维持治疗。6个月时复查 BMI 24.4 kg/m^2 HBG 112g/L WBC 4.63×10E9/L PLT 216×10E9/L ALB 47.5 g/L 超敏CRP 0.63 mg/L 血沉 8 mm/h。
肠镜未见明显异常。术后6个月CTE未见明显异常。
(二)CD肠切除术后仍有残余肠道病变患者的管理
CD术后仍有残余肠道病变的原因:病变广泛,部分肠段出现严重并发症(狭窄、穿孔、出血)药物不能控制;
这类患者的治疗原则:肠道手术后仍有活动性病变,应积极重新诱导缓解。
建议术后治疗方案: 抗-TNF药物和(或)免疫抑制剂;全肠内营养和(或)免疫抑制剂治疗(适用于有营养治疗适应症,或既往英夫利西单抗无效者)。
分享两例此种类型的病例:
病例1,术后仍有残余病变—英夫利西单抗诱导缓解
患者男性,35岁。主诉:反复腹痛、腹泻11年。诊断:克罗恩病(回结肠型 穿透型 活动期中度)
病史:2007年开始出现腹痛、腹泻、排粘液便,偶有果酱样便,当地医院就诊,考虑CD,于美沙拉嗪治疗,症状反复;2011年腹痛加重,至广州某医院就诊,查肠镜示回结肠多发溃疡,诊断CD,予激素、AZA治疗,症状缓解,并用AZA维持5年;2017年1月出现肠梗阻,至广州中山六院就诊。
腹部平片提示多段小肠积气增多,并见多个气液平,最宽肠袢约7cm。腹部CT提示:第6组部分小肠节段性病变伴梗阻及肠间瘘。
对症处理后梗阻未缓解,于2017-1-20行回盲部+小肠部分切除+回肠升结肠双腔造口术。
术后病理:小肠病变处粘膜糜烂,伴炎性肉芽组织形成,可见幽门腺化生,粘膜肌增生,排列紊乱,粘膜下层及浆膜层纤维组织增生,肠壁局部可见透壁性炎,淋巴组织稍增生,固有肌层及浆膜层神经束增生,考虑为克罗恩病。
术后予甲氨蝶呤(MTX)维持治疗,无不适。
2017年7月患者坚决要求造口回纳。于2017-8-2全麻下行回结肠造口关闭术。术后间断排暗红色血便,每次血量30-50 ml 。
急诊肠镜结果考虑疾病仍有活动,于2017-8-19开始英夫利西单抗治疗。
第4次使用英夫利西单抗前复查,无腹痛、便血,体重增加3kg, 大便OB(-)。HBG 117g/L WBC 5.18×10E9/L PLT 208×10E9/L ALB 50.0 g/L 超敏CRP 2.05 mg/L 血沉 17 mm/h。
病例2,术后仍有残余病变——全肠内营养(EEN)诱导缓解
患者女性,43岁。主诉:反复腹痛10年,黑便5年。诊断:克罗恩病(回结肠型 穿透型 活动期中度)。
病史:2007年开始出现腹痛。2010年外院就诊,发现结肠狭窄,考虑CD并行右半结肠部份切除术,术后缓解。2013年再次出现腹痛,伴有黑便,体重下降。2015年10月于我院就诊。
肠镜提示克罗恩病伴结肠狭窄,溃疡形成。
CTE提示:第3、4、5组部分小肠、降结肠、乙状结肠肠壁增厚,右下腹可疑肠间瘘形成,并不全性小肠梗阻。
2015-10-26予全肠内营养(EEN) 3个月 +硫唑嘌呤(AZA) 50mg Qd治疗,症状缓解,体重增加5kg。2016年6月再次因腹痛至广州中山六院就诊:
肠镜提示:乙状结肠距肛缘40cm,见肠腔狭窄,黏膜充血红肿伴溃疡形成。
CTE提示:右中下腹部分小肠及降结肠下段局部肠壁增厚情况较前进展。
再次予EEN治疗后于2016-9-21行回结肠切除+小肠部分切除+回肠-降结肠侧侧吻合+回肠双腔造口术,并予AZA维持治疗,2016-12-29行“小肠部分切除+回肠造口关闭术”术后予AZA维持治疗,无不适。
术后病理:肠壁全层透壁性炎,伴炎性肉芽组织形成,粘膜下层及浆膜层淋巴组织增生,伴淋巴小结形成,肠壁纤维组织增生,病变符合克罗恩病。
2017-10-20出现肠梗阻再次至我院就诊。查体:腹软,脐周有压痛,无反跳痛,未触及包块。入院检查:HBG 91g/L WBC 4.47×10E9/L N 75.4% PLT 295×10E9/L ALB 34.1 g/L 超敏CRP 32.1 mg/L 血沉 52 mm/h BMI 22.6 kg/m^2。
手术探查,发现小肠多发膜状粘连。原回结肠吻合口近端约10cm处小肠环形狭窄,累及肠管约3cm,近端约50cm处小肠与该处狭窄粘连纠集并小脓肿,分离后未见其余肠管狭窄。距原回结肠吻合口约20cm处见另一小肠吻合口,未见狭窄。根据探查结果,决定行“回肠部分切除+肠排列术”。
术后予EEN治疗3个月,反应停维持。2018-2-22复查(EEN 3个月) BMI 24.8 kg/m^2 HBG 111g/L WBC 5.56×10E9/L PLT 236×10E9/L ALB 39.3 g/L 超敏CRP 0.05 mg/L 血沉 12 mm/h。CTE结果明显好转。
总 结
肠道切除术诱导缓解的复发高危CD患者,术后早期应开始药物治疗,预防术后复发,常用巯嘌呤类药物和/或生物制剂,生物制剂效果最佳;
内窥镜是监测术后复发的金标准,应在术后6月~1年内执行;
根据内镜结果优化治疗方案,是目前最好的复发预防策略;
粪便钙卫蛋白与内镜复发具有相关性,未来FC辅助的监测策略仍需进一步的研究;
CTE、MRE和胃肠道彩超作为内窥镜的有效补充手段,可发现肠道外并发症;
部分CD患者在手术后仍残余活动的病变肠段,需积极诱导缓解,可选用抗-TNF生物制剂 ± 免疫抑制剂或全肠内营养。
本文转自IBD学术情报官


